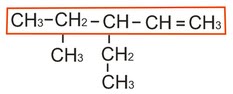
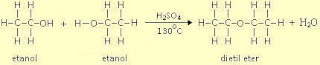
Salin Materi
Di alam daur ini sebagai berikut: Awalnya karbon dioksida diserap oleh tumbuhan melalui fotosintetis dijadikan glukosa. Lalu disusun menjadi amilum, kemudian diubah menjadi senyawa gula yang lain, lemak, protein, dan vitamin. Pada proses pernafasan tumbuhan, dihasilkan lagi karbondioksida dan oksigen. Daur oksigen juga sama.
| Daur Karbon dan Oksigen |
Karbon merupakan bahan dasar dari semua bahan organik. Aliran karbon berjalan beriringan secara paralel dengan aliran energi. Sumber pokok karbondioksida (CO2) ada di atmosfer. Selain itu, komponen karbon juga tersedia dalam bahan bakar fosil (batu bara, gas alam, dan minyak). Karbondioksida (CO2) disatukan ke dalam sistem biotik melalui fotosintesis. Siklus ini secara esensial ialah siklus karbondioksida (CO2). Oksigen (O2) digunakan selama pembakaran dan pemecahan energi, bersamaan dengan dihasilkannya karbondioksida.
Karbon dioksida di atmosfer merupakan sumber karbon bagi tumbuhan, terutama ketika melakukan fotosintesis. Karbon tersebut dapat berpindah ke hewan ketika mereka memakan tumbuhan. Selanjutnya, tubuh hewan dan tumbuhan yang sudah mati akan diuraikan oleh mahkluk hidup pengurai menjadi karbondioksida, air, dan mineral. Karbondioksida akan kembali ke atmosfer dari penguraian juga melalui sistem respirasi.
Proses timbal balik fotosintesis dan respirasi seluler bertanggung jawab atas perubahan dan pergerakan utama karbon. Naik turunnya CO2 dan O2 atsmosfer secara musiman disebabkan oleh penurunan aktivitas Fotosintetik. Dalam skala global kembalinya CO2 dan O2 ke atmosfer melalui respirasi hampir menyeimbangkan pengeluarannya melalui.
Akan tetapi pembakaran kayu dan bahan bakar fosil menambahkan lebih banyak lagi CO2 ke atmosfir. Sebagai akibatnya jumlah CO2 di atmosfer meningkat. CO2 dan O2 atmosfer juga berpindah masuk ke dalam dan ke luar sistem akuatik, dimana CO2 dan O2 terlibat dalam suatu keseimbangan dinamis dengan bentuk bahan anorganik lainnya.
Dua hal Penting yang dipahami pada Daur ini yaitu:
- Peristiwa Fotosintesis
- Peristiwa Respirasi
Proses timbal balik fotosintesis dan respirasi seluler bertanggung jawab atas perubahan dan pergerakan utama karbon. Naik turunnya CO2 dan O2 atsmosfer secara musiman disebabkan oleh penurunan aktivitas Fotosintetik. Dalam skala global kembalinya CO2 dan O2 ke atmosfer melalui respirasi hampir menyeimbangkan pengeluarannya melaluifotosintesis.
Akan tetapi pembakaran kayu dan bahan bakar fosil menambahkan lebih banyak lagi CO2 ke atmosfir. Sebagai akibatnya jumlah CO2 di atmosfer meningkat. CO2 dan O2 atmosfer juga berpindah masuk ke dalam dan ke luar sistem akuatik, dimana CO2 dan O2 terlibat dalam suatu keseimbangan dinamis dengan bentuk bahan anorganik lainnya.
Yang terpenting untuk dipahami dalam siklus Biogeokimia ini ada 3 hal pokok yaitu terjadi daur aliran zat kimia dari Bio ke Geo atau dari Mahkluk hidup ke Bumi ( penguraian , zat sisa ekskresi dll yang ditujukan kebumi dari mahkluk hidup terjadi daur aliran zat kimia dari Geo ke Bio yang tidak lain adalah pemanfaatan zat kimia entah dalam bentuk organik maupun anorganik, biasanya oleh tumbuhan lewat akarnya
terjadi daur aliran zat kimia dari Geo ke Geo maksudnya senyawa kimia di udara bisa pindah ke darat misalnya lewat hujan - darat ke udara - darat ke air - air ke darat dll yang semua itu pasti untuk suatu keseimbangan . OK untuk daur aliran zat dari Bio ke Bio tentu sudah anda bisa ketahui di Rantai makanan atau Jaring makanan.
Siklus Karbon dan Oksigen
Di atmosfer terdapat kandungan CO2 sebanyak 0.03%. Sumber-sumber CO2 di udara berasal dari respirasi manusia dan hewan, erupsi vulkanik, pembakaran batubara, dan asap pabrik.
Karbon dioksida (CO2)di udara dimanfaatkan oleh tumbuhan untuk berFotosintesis dan menghasilkan oksigen yang nantinya akan digunakan oleh manusia dan hewan untuk ber Respirasi.
Hewan dan tumbuhan yang mati, dalam waktu yang lama akan membentuk batubara di dalam tanah. Batubara akan dimanfaatkan lagi sebagai bahan bakar yang juga menambah kadar C02 di udara.
Di ekosistem air, pertukaran C02 dengan atmosfer berjalan secara tidak langsung.
Karbon dioksida berikatan dengan air membentuk asam karbonat yang akan terurai menjadi ion bikarbonat.
Bikarbonat adalah sumber karbon bagi alga yang memproduksi makanan untuk diri mereka sendiri dan organisme heterotrof lain. Sebaliknya, saat organisme air berespirasi, CO2 yang mereka keluarkan menjadi bikarbonat. Jumlah bikarbonat dalam air adalah seimbang dengan jumlah C02 di air.
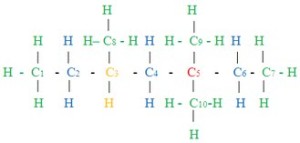
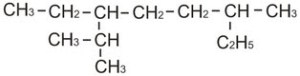
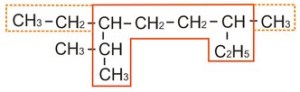
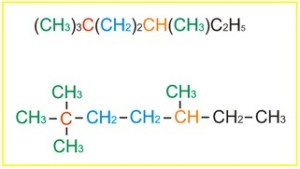
Demikianlah paparan materi tentang daur karbon dan oksigen kali ini. Rekan juga dapat melihat materi kimia lainnya seperti Kegunaan Alkiloid Dalam Kehidupan Sehari-Hari, Alkana, Alkena dan Alkuna, Reaksi-Reaksi Senyawa Karbon dan masih banyak lagi yang lain di Materi Pelajaran Kimia.
Proses timbal balik fotosintesis dan respirasi seluler bertanggung jawab atas perubahan dan pergerakan utama karbon. Naik turunnya CO2 dan O2 atsmosfer secara musiman disebabkan oleh penurunan aktivitas Fotosintetik. Dalam skala global kembalinya CO2 dan O2 ke atmosfer melalui respirasi hampir menyeimbangkan pengeluarannya melalui.
Dua hal Penting yang dipahami pada Daur ini yaitu:
- Peristiwa Fotosintesis
- Peristiwa Respirasi
Proses timbal balik fotosintesis dan respirasi seluler bertanggung jawab atas perubahan dan pergerakan utama karbon. Naik turunnya CO2 dan O2 atsmosfer secara musiman disebabkan oleh penurunan aktivitas Fotosintetik. Dalam skala global kembalinya CO2 dan O2 ke atmosfer melalui respirasi hampir menyeimbangkan pengeluarannya melaluifotosintesis.
Akan tetapi pembakaran kayu dan bahan bakar fosil menambahkan lebih banyak lagi CO2 ke atmosfir. Sebagai akibatnya jumlah CO2 di atmosfer meningkat. CO2 dan O2 atmosfer juga berpindah masuk ke dalam dan ke luar sistem akuatik, dimana CO2 dan O2 terlibat dalam suatu keseimbangan dinamis dengan bentuk bahan anorganik lainnya.
Yang terpenting untuk dipahami dalam siklus Biogeokimia ini ada 3 hal pokok yaitu terjadi daur aliran zat kimia dari Bio ke Geo atau dari Mahkluk hidup ke Bumi ( penguraian , zat sisa ekskresi dll yang ditujukan kebumi dari mahkluk hidup terjadi daur aliran zat kimia dari Geo ke Bio yang tidak lain adalah pemanfaatan zat kimia entah dalam bentuk organik maupun anorganik, biasanya oleh tumbuhan lewat akarnya
terjadi daur aliran zat kimia dari Geo ke Geo maksudnya senyawa kimia di udara bisa pindah ke darat misalnya lewat hujan - darat ke udara - darat ke air - air ke darat dll yang semua itu pasti untuk suatu keseimbangan . OK untuk daur aliran zat dari Bio ke Bio tentu sudah anda bisa ketahui di Rantai makanan atau Jaring makanan.
Siklus Karbon dan Oksigen
Di atmosfer terdapat kandungan CO2 sebanyak 0.03%. Sumber-sumber CO2 di udara berasal dari respirasi manusia dan hewan, erupsi vulkanik, pembakaran batubara, dan asap pabrik.
Karbon dioksida (CO2)di udara dimanfaatkan oleh tumbuhan untuk berFotosintesis dan menghasilkan oksigen yang nantinya akan digunakan oleh manusia dan hewan untuk ber Respirasi.
Hewan dan tumbuhan yang mati, dalam waktu yang lama akan membentuk batubara di dalam tanah. Batubara akan dimanfaatkan lagi sebagai bahan bakar yang juga menambah kadar C02 di udara.
Di ekosistem air, pertukaran C02 dengan atmosfer berjalan secara tidak langsung.
Karbon dioksida berikatan dengan air membentuk asam karbonat yang akan terurai menjadi ion bikarbonat.
Bikarbonat adalah sumber karbon bagi alga yang memproduksi makanan untuk diri mereka sendiri dan organisme heterotrof lain. Sebaliknya, saat organisme air berespirasi, CO2 yang mereka keluarkan menjadi bikarbonat. Jumlah bikarbonat dalam air adalah seimbang dengan jumlah C02 di air.
Salin Materi
Demikianlah paparan materi tentang daur karbon dan oksigen kali ini. Rekan juga dapat melihat materi kimia lainnya seperti Kegunaan Alkiloid Dalam Kehidupan Sehari-Hari, Alkana, Alkena dan Alkuna, Reaksi-Reaksi Senyawa Karbon dan masih banyak lagi yang lain di Materi Pelajaran Kimia.